Клинический случай дирофиляриоза у кошки
Тезисы II Ветеринарного кардиологического конгресса
6–7 июня 2022 г. Москва, отель «Милан»
Клинический случай дирофиляриоза у кошки
Светлана Алексеевна Лутченкова, Наталья Васильевна Мочалова
Ветеринарная клиника «Корветцентр» г. Королев Московская область
Обзор литературы
Перечень сокращений и условных обозначений:
АД – артериальное давление
АЛТ – аланинаминотрансфераза
АСТ — аспартатаминотрансфераза
В/в — внутривенно
КТ – компьютерная томография
ПЖ – правый желудочек
ПЦР – полимеразная цепная реакция
СНК – скорость наполнения капилляров
ЧСС – частота сердечный сокращений
Ag — антиген
- immitis – Dirofilaria immitis
dКПВ/dАо диаметр каудальной полой вены/диаметр аорты
FeLV – вирусная лейкемия кошек
FIV – вирусный иммунодефицит кошек
HARD – heartworm associated respiratory disease
HWD — heartworm disease (дирофиляриоз)
Mmol/L -millimoles per litre – ммоль/л
U/l — Unit per liter — Ед/л
Распространение
Dirofilaria immitis распространена по всему миру в тропических и умеренных регионах и является эндемичной в некоторых странах Европы, Северной и Южной Америки. В РФ в последние годы география заболевания расширилась и уже достигла отметки в 56°-57° северной широты в европейской и азиатской частях РФ (Anatoly V et al, 2020).
Распространение дирофиляриоза у кошек трудно оценить из-за диагностических трудностей, случаи заражения выявляются в тех же областях, что и у собак, однако уровень заражения взрослыми дирофиляриями у кошек по разным данным колеблется от 5 % до 20 % от уровня в местной популяции собак. Исследования уровня антител к D. immitis у кошек показывают, что подверженность инвазии может быть намного выше (Venco et al., 2011a; Montoya-Alonso et al., 2011, 2016; Diakou et al., 2019).
Уличные кошки подвергаются большему риску быть укушенными зараженными комарами, чем их домашние собратья, однако, по данным исследований, около 30 % зараженных кошек имели исключительно квартирное содержание. Нет достоверных данных относительно породной и половой предрасположенности к развитию дирофиляриоза в естественных условиях. Однако есть сообщения о возможно более высокой вероятности развития взрослых гельминтов у самцов в экспериментальных исследованиях (Levy et al., 2017).
Отсутствует корреляция между дирофиляриозом и такими хроническими инфекциями кошек, как FeLV, FIV и токсоплазмоз. Два исследования не выявили связи между дирофиляриозом и коинфекциями FIV или FeLV. При этом у самцов некастрированных кошек риск заражения дирофиляриозом, FeLV и FIV был выше, чем у самок. Другое исследование 2017 года показало, что кошки с ретровирусными инфекциями, особенно FIV, имели заметное увеличение серопозитивности к D. immitis, однако не исключалось, что это связано с общими фактором свободного доступа на улицу.
Помимо Dirofilaria immitis нематода метастронгилида (Angiostrongylus chabaudi) иногда обнаруживается в правом желудочке и легочных артериях европейских диких кошек (Giannelli et al., 2016). Хотя описан ряд случаев, патологические данные, согласующиеся с инфекцией Angiostrongylus, не были очевидны, поэтому эта паразитарная инфекция не считается клинически значимой для домашних кошек.
Возбудитель
Филярии (Spirurida, Onchocercidae) являются трансмиссивными нематодами, поражающими в основном собак, а также кошек, хорьков, диких плотоядных (лисы, шакалы, койоты, волки, еноты, дикие кошачьи, морские львы, черные медведи) и людей (McCall et al., 2008; Simón et al., 2012; Otranto and Deplazes, 2019), однако резервуаром инвазии являются в основном собаки и дикие псовые.
Взрослые особи Dirofilaria immitis (самки 25–30 см x ~1 мм; самцы 12–20 см x 0,7–0,9 мм) обитают в легочных артериях и правых отделах сердца.
В длительном жизненном цикле этих нематод участвует промежуточный хозяин — комар (в Европе в основном Culex pipiens, Aedes vexans и Aedes albopictus), который заражается при питании кровью резервуарного хозяина, несущего достаточное количество циркулирующих микрофилярий (Cancrini et al., 2006; 2007; McCall et al., 2008; Simon et al., 2012). В промежуточном хозяине проходят стадии развития от L1 до L3, что может занимать от 10-14 дней до 4 недель в зависимости от температуры окружающей среды. (Taylor, 1960).
Личинки L3 попадают через место укуса в подкожную клетчатку нового хозяина со слюной кормящейся самки, где в течение пары дней линяют до личинок L4, мигрируют в подкожную жировую ткань и мышцы в течение следующих 2 месяцев, в конечном итоге претерпевают окончательную линьку до стадии ювенильного гельминта и попадают в периферическую вену. У кошек, в отличие от собак, после инокуляции только небольшое количество личинок L3 развивается до взрослой стадии у небольшого процента кошек, и для этого требуется около 7-9 месяцев (по другим данным 6-7 месяцев). (McCall et al, 1992, Dillon et al, 2007, McCall, unpublished data). То есть у кошек большинство ювенильных гельминтов погибает вскоре после попадания в легочные артерии, вызывая воспалительную реакцию. У небольшого процента кошек несколько гельминтов становятся взрослыми особями, причем их количество обычно не превышает 1-6 взрослых особей. (McCall et al, 1992, Dillon et al, 2007, McCall, unpublished data).
У кошек гораздо выше вероятность развития однополой инфекции (только самцы) по сравнению с собаками. Более того, продукция микрофилярий у кошек происходит редко (всего 20% кошек со зрелыми самками и самцами гельминтов), а если продукция микрофилярий все же происходит, то в кошачьей крови она длится всего несколько месяцев и в небольшом количестве. (McCall et al., 2008; Simon et al., 2012) У кошек взрослые гельминты мельче, продолжительность их жизни короче (до 2-4 лет) по сравнению с собаками (более 7 лет), и чаще встречаются эктопические локализации вследствие аберрантных миграций личиночных стадий (McCall et al., 2008); (Simón et al., 2012).
Клинические признаки заболевания и патогенез
Клинические признаки дирофиляриоза у кошек больше связаны с иммунным ответом (гиперреактивностью), чем с сердечной недостаточностью. У кошек развивается заболевание легких, сопровождающееся респираторным дистресс-синдромом и хроническим кашлем или рвотой.
На данный момент Американское общество дирофиляриоза выделяет в развитии заболевания у кошек на две стадии:
Первая стадия начинается вскоре после попадания ювенильных гельминтов (стадия L5) в каудальные легочные артерии (примерно через 3 месяца после заражения) как острая сосудистая и паренхиматозная воспалительная реакция на присутствие и последующую гибель большинства этих гельминтов. Легочный эндомезоартериит с окклюзионной медиальной гипертрофией наблюдается на данной стадии (Dillon et al., 2007; 2014). Наиболее распространенными клиническими признаками являются кашель или одышка (64%) и перемежающаяся рвота, не связанная с приемом пищи (38%), 28% кошек не имеют симптомов. На рентгенограмме грудной клетки можно выявить бронхо-интерстициальный паттерн и увеличение тени правой каудальной долевой артерии. Развитие поражений сосудов легких, бронхов и паренхимы (Holmes et al, 1992; Browne et al; Dillon et al, 2007; Tekla M Lee-Fowler et al), а также изменение легочной функции ((L García-Guasch et al) даже при отсутствии взрослых дирофилярий привело к появлению отдельного термина – HARD — респираторное заболевание, связанное с сердечными гельминтами.
По мере созревания гельминтов воспалительная реакция ослабевает, частично из-за того, что взрослые гельминты подавляют активность легочных внутрисосудистых макрофагов, основного компонента ретикулоэндотелиальной системы кошек, поэтому клинические признаки могут ослабевать, хотя поражения сосудов и бронхов сохраняются.
Поскольку у кошек обычно небольшое количество гельминтов и они имеют относительно короткую продолжительность жизни, клинически значимая легочная гипертензия, гипертрофия правого желудочка и правожелудочковая недостаточность у кошек, инфицированных дирофиляриями, встречаются реже, чем у собак, что было доказано в исследовании. Предполагается, что это связано с развитым коллатеральный кровообращением в легких у кошек. В том же исследовании отмечено снижение коллагена в миокарде ПЖ у зараженных кошек, что достоверно коррелировало с тяжестью поражения легочной паренхимы и артерий. (Randolph L et al)
Эти особенности позволяют многим кошкам переносить инфекцию без видимых клинических признаков до тех пор, пока половозрелые гельминты не начнут погибать, что инициирует вторую стадию проявления болезни. Дегенерирующий паразит вызывает интенсивную воспалительную реакцию и тромбоэмболию, что может привести к катастрофическому острому повреждению легких и внезапной смерти. (Atkins et al, 2000; McCall et al, 2008). Сообщалось о внезапной смерти от 10 % до 20 % кошек со зрелыми дирофиляриями. Такие реакции у кошек могут возникать даже при заражении одним гельминтом в результате его гибели. (Dillon et al, 2008).
Согласно экспериментальным исследованиям, острая системная анафилаксия, вторичная по отношению к высвобождению больших количеств антигенов D. immitis из мертвых гельминтов, лежит в основе этой формы течения болезни. Проявления сверхострого течения могут включать респираторный дистресс, атаксию, коллапс, судороги, кровохарканье или иногда внезапную смерть. Реже сообщалось о таких проявлениях, как асцит, гидроторакс, хилоторакс, пневмоторакс, атаксия, судороги и обмороки. Синдром каудальной полой вены может возникать при локализации 1-2 гельминтов в правой половине сердца и развитии трикуспидальной регургитации, но встречается редко.
У большинства кошек происходит транзиторное и хроническое течение дирофиляриоза с легкими или умеренными респираторными симптомами в результате бронхоальвеолярного воспаления, сохраняющегося даже после гибели паразита. Это может привести к хроническому респираторному заболеванию, которое некоторые исследователи рассматривают как третью стадию заболевания.
Аберрантные миграции паразита в полости тела, центральную нервную систему, бедренные артерии чаще регистрируют у кошек, чем у собак и приводят к выпотам или таким неврологические проявлениям как слепота, атаксия, парапарез, монопарез и судороги (McCall et al. al., 2008; Simon et al., 2012; Favole et al., 2013; Oldach et al., 2018).
Трудности диагностики
Диагностика должна быть комплексной и включать тестирование на антиген, антитела, рентгенографию и эхокардиографию.
У кошек обнаруживаемая антигенемия развивается примерно через 5,5–8 месяцев после заражения (McCall et al, 1998; Stewart et al, 1992). У экспериментально зараженных кошек положительный результат теста на Ag регистрировался у 86 % кошек, инфицированных взрослыми дирофиляриями (Atkins et al). Описаны как ложноотрицательные результаты, так и ложноположительные, что связывали с легкой степенью инвазии, неполовозрелой или однополой инвазией (Genchi et al, 1998; McCall et al, 1998), гипергаммаглобулинемией вследствие хронического воспалительного процесса, аберрантными миграциями, комплексами антиген-антитело. (Little et al, 2014). Среди различных тестов на антиген наилучшие показатели чувствительности и специфичности продемонстрировал тест Dirochec Ag (P S Snyder et al, 2000).
Преимущество тестов на антитела состоит в том, что они позволяют выявить инфекцию уже через 2 месяца после инфицирования (McCall JW et al., 1995). Положительный результат может отмечаться как при контакте с личиночной стадией или неполовозрелой инвазии, так и при инвазии взрослыми гельминтами или предшествующей инвазии после самоизлечения. Это является значительным ограничением этого метода. Также может отличаться чувствительность различных тестов к разным стадиям развития дирофилярий. Вскрытие естественно инфицированных кошек из приютов показало значительную вариабельность чувствительности тестов от 32 % до 89 % (Berdoulay et al, 2004; Snyder et al, 2000; Nelson and Self, 1998).
На рентгенограммах выявляют диффузный бронхо-интерстициальный легочный паттерн, неоднородные инфильтраты вокруг каудальных долевых артерий в результате выхода плазмы и периваскулярного воспаления (Venco et al., 2015). Другие проявления включают гиперинфляцию легких с уплощением диафрагмы, очаговое повышение рентгеноплотности паренхимы легких, консолидацию доли легкого, плевральный выпот и пневмоторакс (Schafer and Berry, 1995; Selcer et al, 1996). Легочная тромбоэмболия, артериальные изменения и коллапс бронхов являются частыми находками, когда кошкам с дирофиляриозом проводят компьютерную томографию (КТ) или ангиографию грудной клетки (Dillon et al., 2014; Panopoulos et al., 2018). В некоторых случаях дирофиляриоза кошек рентгенограммы грудной клетки не имеют признаков инфекции (Selcer et al, 1996). Инфекция видами Toxocara cati и Aelurostrongylus может вызывать сходные рентгенологические картины и должна учитываться при дифференциальной диагностике (Browne et al, 2005; Mackenzie, 1960; Swerczek et al, 1970; Dillon et al, 2013).
Дирофилярий можно увидеть в правых отделах сердца, легочной артерии или дистальных отделах каудальной полой вены с помощью эхокардиографии (Diakou et al., 2019). Кутикула взрослого гельминта сильно эхогенна, образует короткие, сегментированные, параллельные линейные артефакты («железнодорожные рельсы») там, где плоскость изображения пересекает тело паразита, создавая характерные признаки живых червей (Selcer et al, 1996). Иногда мертвых гельминтов можно распознать по коллапсу параллельных сторон стенки тела. Это исследование полезно для выявления взрослых форм дирофилярий и имеет неплохую чувствительность и высокую специфичность, но зависит от опыта оператора. Количественная оценка паразитов затруднена.
Лабораторная диагностика может выявить эозинофилию через 3-5 месяцев после заражения при общем анализе крови и при цитологическом исследовании бронхоальвеолярного лаважа, а также повышение некоторых белков острой фазы.
Циркулирующие микрофилярии редко обнаруживаются у инфицированных кошек (Browne et al, 2005). Взрослые дирофилярии, трансплантированные от кошек, способны возобновлять продукцию циркулирующих микрофилярий у собак (JW McCall, 2014); таким образом, диагностика затруднена еще и из-за иммуноопосредованного клиренса микрофилярий в организме кошки и, возможно, обратимого подавления продукции микрофилярий.
ПЦР исследование редко используются для диагностики дирофияляриоза у кошек.
Ограничения все этих тестов были подтверждены в исследованиях. Кошки с сокращенной инфекцией и кошки со взрослыми дирофиляриями, предыдущими инвазиями не могли быть дифференцированы на основе рентгенографических изменений, серологических титров антител, полного анализа крови или цитологии бронхоальвеолярного лаважа в любой момент времени.
Патоморфология
Вскрытие является единственным диагностическим методом, доступным в случаях внезапной смерти, а также для подтверждения заболевания, когда в подозрительных случаях получены отрицательные результаты методов прижизненной диагностики (Biasato et al., 2017). В этих случаях правые отделы сердца, легочные артерии и эктопические участки, включая головной и спинной мозг при неврологических симптомах, должны быть тщательно обследованы на наличие взрослых гельминтов (McCall et al., 2008; Simon et al., 2012; Jons et al., 2014). Особое внимание следует уделить исследованию дистальных отделов легочных артерий, так как любые мертвые гельминты или их фрагменты будут вытеснены током крови в самые дистальные участки артерий (Miller et al, 1998).
Лечение и последующее наблюдение
Не существует адюльтицидного препарата, одобренного для лечения кошачьего дирофиляриоза, такая терапия не рекомендована бессимптомным кошкам, поскольку в большинстве случаев спонтанное выздоровление происходит в течение 18–48 месяцев (Venco et al., 2008; Jones et al., 2014). Адюльтицидная терапия сопряжена с высоким риском легочной тромбоэмболии и анафилактических реакций после гибели гельминта у подвергшихся лечению кошек (Jones et al., 2014; Alho et al., 2016). Меларсомин, используемый для лечения собак токсичен для кошек даже в таких низких дозах, как 3,5 мг/кг (Goodman, 1996; McLeroy, 1998).
Ивермектин в дозе 24 мкг/кг ежемесячно в течение 2 лет снижает количество гельминтов на 65% по сравнению с кошками, не получавшими лечения (Guerrero et al, 2002). Но в настоящее время рутинно не рекомендован.
Преднизолон (2 мг/кг/сутки, с постепенным снижением дозы до 0,5 мг/кг через день в течение нескольких недель и последующим прекращением через 2 недели) следует давать кошкам с респираторными симптомами, которые дают положительный результат при тестировании на антигены и/или антитела (Jones et al., 2014). Аналогичный подход для бессимптомных кошек с характерными рентгенографическими изменениями.
Сверхострые случаи HWD требуют стабилизации в отделении интенсивной терапии из-за риска дыхательной недостаточности и шока. Состояние кошек с острым респираторным дистресс-синдромом следует немедленно стабилизировать с помощью оксигенотерапии через интраназальные канюли или в кислородных боксах, введения сбалансированных кристаллоидов, а также внутривенных стероидов и бронходилататоров. Аспирин и другие НПВС, а также фуросемид не рекомендованы.
Хирургические процедуры для механического удаления взрослых паразитов были предложены у симптомных кошек для извлечения гельминтов, визуализированных в правых отделах сердца и ветвях легочной артерии, и этот метод является более предпочтительным, чем адюльтицидная терапия, но гельминты должны быть удалены целыми, чтобы избежать анафилаксии (Iizuka et al., 2009; Jones et al., 2014). Описаны хирургические доступы через яремную вену (Venco et al, 1998b, Borgarelli et al, 1997), правую атриотомию с использованием тотальной окклюзии венозного притока, через вентрикулотомический кисетный разрез (Glaus et al, 1995; Rawlings et al, 1994), также описана основная легочная артериотомия.
Профилактика
Из-за непредсказуемого и потенциально смертельного течения дирофиляриоза у кошек и отсутствия безопасных и эффективных методов лечения в эндемичных районах всем кошкам, независимо от их выхода на улицу, следует проводить ежемесячную химиопрофилактику с 2-месячного возраста в течение всего года для уничтожения инфекционных возбудителей. личинки на стадиях L3-L4 (Jones et al., 2014). Та же рекомендация дается для кошек, которые живут в районах, где нет дирофиляриоза, но путешествуют в эндемичные районы. Химиопрофилактику следует проводить в течение 30 дней после прибытия в зону риска (Европейский научный совет по паразитам животных-компаньонов, 2012 г.; Европейское общество дирофиляриоза и ангиостронгилеза, 2017 г.).
В настоящее время для кошек доступно пять профилактических препаратов, которые ежемесячно назначают перорально или местно в виде капель на холку (Baker et al., 2014; Dillon et al., 2014; Little et al., 2015; McTier et al., 2019)
Клинический случай
В марте 2022 года в ветеринарную клинику «Корветцентр» поступил кот Вискас породы шотландская вислоухая в возрасте 12 лет. Владельцы отмечали снижение активности, отказ от еды и появление гнойной раны в области подбородка.
Анамнез: содержание квартирное с выгулом на улицу в летний период, кормление промышленными кормами, вакцинации и профилактические обработки не выполняли в течение трех лет. Общее состояние животного оценивали как тяжелое. Аппетит снижался в течение месяца и отсутствовал три дня перед поступлением, владельцы отмечали периодическую рвоту кормом. Стул отсутствовал в течение трех дней, жажда была повышена, увеличение объема мочи или частоты мочеиспусканий не замечали. Отмечали учащение дыхания, кашля не наблюдали.
Данные осмотра:
Вес 5,5 кг, ЧСС 160 уд\мин, дыхание 45 дд\мин, температура 40,4 °C; АД 110\74 (92) мм рт. ст.; габитус: телосложение среднее, упитанность ниже нормы, поза естественная, темперамент возбудимый. Волосяной покров тусклый, кожа сухая, тургор снижен, дегидратация 6 %, гнойное язвенное поражение кожи в области подбородка, с выраженной болезненностью, слизистые оболочки бледные-розовые, чистые, СНК 1 сек, поверхностные лимфоузлы увеличены подчелюстные, живот умеренно напряженный, печень пальпаторно значительно выступает за край реберной дуги, верхушечный толчок сердца локализован в 5-ом межреберье, по ширине локализован, по величине умеренный, по силе усиленный, артериальный пульс билатеральный, ритмичный, умеренный по напряжению, умеренный по наполнению, без дефицита, вены нормального наполнения, признаков пульсации нет, гепатоюгулярный рефлекс отрицательный, признаков асцита, периферических отеков нет, трахеальный рефлекс положительный, дыхание симметричное, ритмичное, одышка смешанного типа, тоны сердца ритмичные, систолический шум справа 2\6 громкости, бронхиальный тип основного дыхания, сухие хрипы по всем полям легких.
Назначенные диагностические мероприятия: клинический и биохимический анализы крови, анализы для исключения вирусной лейкемии кошек, вирусного иммунодефицита, ринотрахеита, калицивироза, цитологическое исследование образования кожи на подбородке, рентгенологическое обследование грудной полости, эхокардиография, ультразвуковое исследование брюшной полости.
В связи с финансовыми ограничениями владельцев намеченный диагностический план осуществлялся по мере получения их согласия на манипуляции.
Пациент был помещен в карантинную зону инфекционного стационара. До получения результатов анализов проводили симптоматичесую терапию, включавшую серению 0,6 мл п\к, амоксиван 20 мг\кг в\в, обезболивание (лидокаина 30 мкг \кг\ мин в виде инфузии с постоянной скоростью, анальгин 20 мг\ кг в\в болюсно, инфузионную терапию стерофундином 60 мл , витамин В 12 по 1 мл в\в, габапентин 60 мг внутрь) местные обработки раны, оксигенотерапия. На фоне терапии отмечали незначительное улучшение состояния: нормализацю температуры тела, появление самостоятельного аппетита.
Результаты диагностических тестов:
Результаты анализов крови
По результатам общего анализа крови выявили анемию (гематокрит 22,4, гемоглобин 67, эритроциты 4,8 млн.) и лимфоцитоз 48,3. По результатам биохимического анализа крови определили повышение печеночных трансаминаз (АЛТ 287 U\l, АСТ 296 U\l), нарушение электролитного состава: калий 2.1 mmol\l, натрий 122mmol\l, хлор 81mmol\l), повышение щелочной фосфатазы 66 U\l), при нормальном уровне почечных показателей — 7,11 mmol\l, креатинин 46 mmol \l. ПЦР Иммунодефицит – положительно, ПЦР Вирусная лейкемия – отрицательно.
Результаты цитологического исследования материала из области поражения кожи в области подбородка:
Смешанное бактериальное воспаление с преобладанием нейтрофилов. Реактивная гиперплазия. В списке дифференциальных диагнозов могут быть воспалительные заболевания кожи и фолликулов (фолликулит, фурункулез и т.д.). В данном материале нет данных о злокачественном образовании, однако сильное воспаление может смазывать реальную картину при цитологической диагностике. Рекомендовано повторное цитологическое или гистологическое исследование после применения противоспалительной терапии и при дальнейших предположениях об опухолевой причине поражения.
Заключение ультразвуковой диагностики брюшной полости
Признаки умеренной гепатомегалии, диффузных изменений паренхимы печени, что может соответствовать холингиту/ холангиогепатиту. Признаки холецистита, наличия взвеси в полости желчного пузыря. Признаки билатеральной нефромегалии, выраженных билатеральных диффузных изменений паренхимы почек, что более вероятно соответствует хронической нефропатии (в частности, хроническому интерстициальному нефриту), полностью не могут быть исключены диффузные неопластические процессы. Признаки спленомегалии, умеренных диффузных изменений паренхимы, что может соответствовать сплениту/ узелковой гиперплазии/экстрамедуллярному гемопоэзу/лимфопролиферативным процессам. Признаки переполнения желудка анэхогенным содержимым, атонии желудка, наличия гиперэхогенного включения в просвете (гельминт?); признаки умеренной хронической гастроэнтеропатии. Признаки значительного количества взвеси в полости мочевого пузыря. Признаки умеренного повышения эхогенности сальника, что может соответствовать оментиту или отеку сальника.
Описание рентгенограммы, выполненной в боковой проекции
Трахея расположена под углом 45 по отношению к позвоночнику. Фигура сердца увеличена за счет правых камер. Диаметр артерии превышает диаметра вены правой краниальной доли легких. Каудальная полая вена расширена (dКПВ/dАо более 1,5), признаков плеврального выпота, пневмоторакса нет. Диффузный бронхо-интерстициальный легочный паттерн, неоднородные инфильтраты вокруг долевых артерий. Костные структуры и мягкие ткани без видимой патологии.
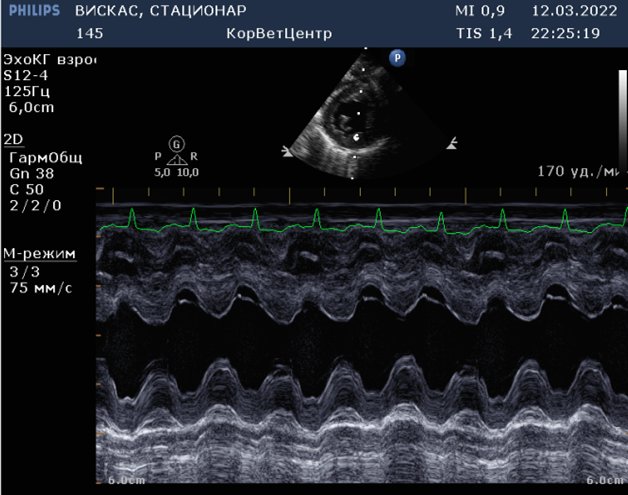
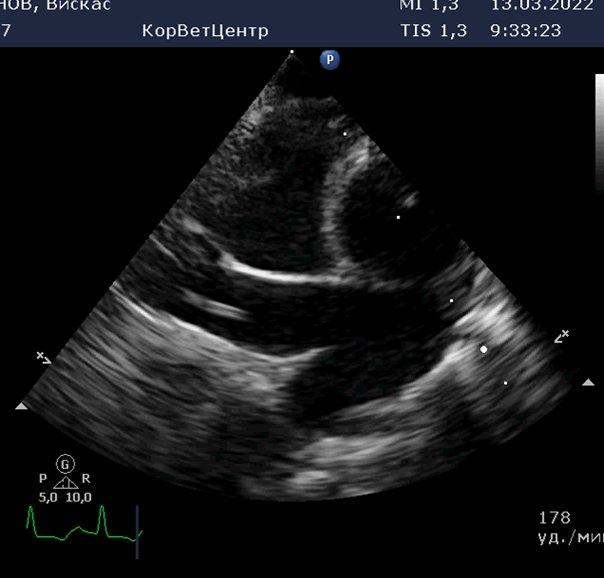
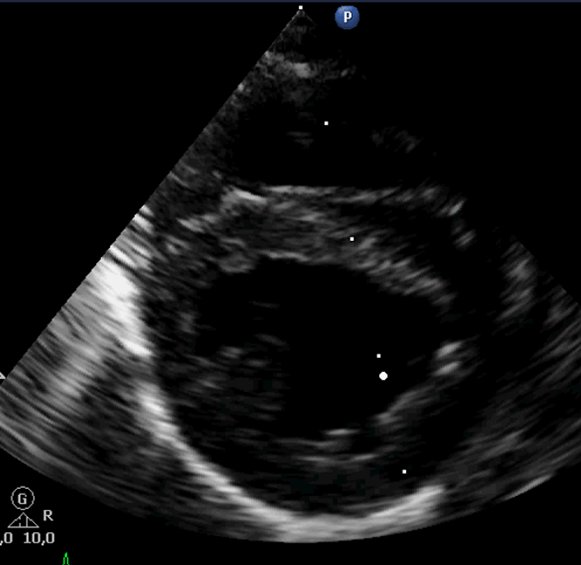
Эхокардиографическое заключение
Эксцентрическая гипертрофия правых отделов сердца, регургитация на трикуспидальном клапане 1 степени. Расширение легочной артерии с регургитацей на клапане легочной артерии 1 степени. Средняя вероятность легочной гипертензии. В полости правой ветви легочной артерии во всех стандартных проекциях визуализируется линейная двухконтурная гиперэхогенная структура, которая может соответствовать дирофилярии. Систолическая функция левого желудочка в норме. Левое предсердия не расширено. Стенки левого желудочка не утолщены. Застоя в малом круге кровообращения нет. Во время исследования регистрировался синусовый ритм с ЧСС 160 уд\мин. Для подтверждения сердечно-легочной формы дирофиляриоза рекомендованы специфические тесты.
Предполагаемый диагноз: пневмония. Неисключенный диагноз: сердечно-легочная форма дирофилляриоза, паразитарный пневмонит.
Коррекция терапии
Преднизолон 1 мг на кг 2 раза в день в\в, марфлоксин 10 % 2 мг на кг в\в 1 раз в день, амоксиван 20 мг на кг в\в 2 раза в день, витамин В12 по 1 мл 1 раз в день, поддерживающая инфузионная терапия с учетом дегидрататции, гипотонии, ионного состава крови, дыхательной недостаточности.
В течение недельного пребывания в стационаре состояние пациента ухудшалось. Отмечали общее угнетение, положение тела на боку, одышку смешанного типа, гипотензию ( АД 80\50 мм рт. ст.), гипотермия, но отмечался самостоятельный сниженный аппетит. По результатам анализов крови прогрессировала анемия и азотемия. За время лечения пациенту помимо основного лечения осуществляли гемотрансфузию, коррекцию гипоальбуминемии, инфузии с постоянной скоростью допамина и норадреналина, кислородотерапию , согревание. На 7 день терапии владельцы приняли решение о проведении гуманной эвтаназии.
Из предложенных лабораторных тестов для диагностики дирофиляриоза владельцы согласились на ПЦР. Результат: отрицательно.
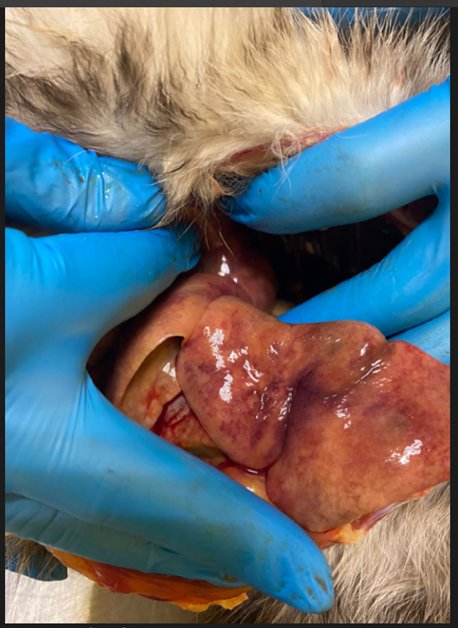
Результаты патоморфологического исследования
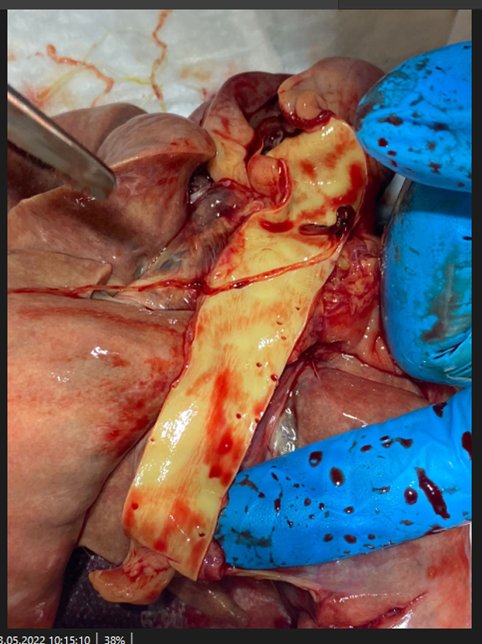
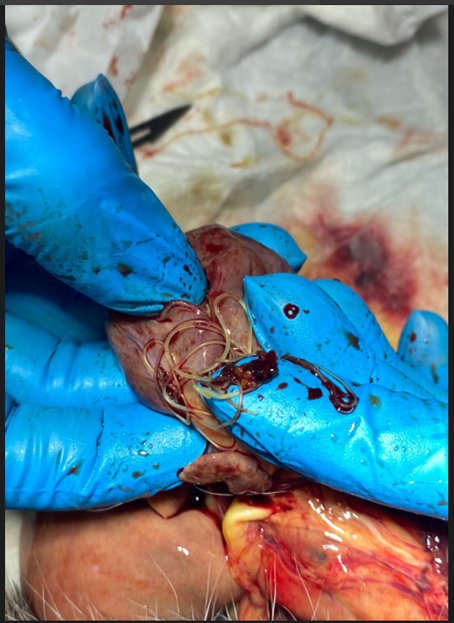
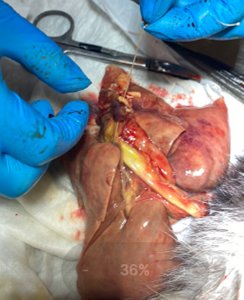
При вскрытии сердца и сосудов легких обнаружены круглые гельминты в количестве 17 штук. По морфологической оценке установлена их принадлежность к виду Dirofilaria immitis . Большая часть гельминтов была найдена в правом желудочке сердца, что не подтверждалось данными эхогкардиорафии, поэтому можно сделать вывод о том, что эти особи сохраняли свою жизнеспособность на момент гибели пациента и мигрировали в правый желудочек из легочных артерий после прекращения кровообращения.
Выводы
- Пациент имел значительное количество патологий внутренних органов, наиболее вероятно возникших на фоне заболевания вирусным иммунодефицитом кошек.
- Взрослые особи дирофилярий, локализирующиеся в сосудах легких, стали причиной развития у пациента дыхательной недостаточности (по — видимому вследствие развития реакций гиперчувствительности замедленного типа).
- Невыясненными остаются причины стойкой гипотонии пациента без ответа на применение препаратов крови, коррекции гипоальбуминемии и инфузий с постоянной скоростью допамина и норадреналина.
Приложение к тезисам
Рис.1 Рентгенограмма пациента в латеральной проекции.
Рис.2.3.4.5 6.7 Эхокардиография. Стрелочкой указана линейная структура в правой ветке легочной артерии-дирофилярия.
Рис.8.9.10.11 Дирофилярии в ветках легочных артерий и правом желудочке при проведении паталогоанатомического вскрытия.
Список литературы:
- Heartworm-associated respiratory disease (HARD) induced by immature adult Dirofilaria immitis in cats A Ray Dillon 1 2, Byron L Blagburn 3, Michael Tillson 3, William Brawner 3, Betsy Welles 3, Calvin Johnson 3, Russell Cattley 3, Pat Rynders 3, Sharron Barney 3 PMID: 29143661 PMCID: PMC5688437 DOI: 10.1186/s13071-017-2452-6
- Serum acute phase proteins in Dirofilaria immitis and Wolbachia seropositive catsAna C Silvestre-Ferreira 1 2, Lisete Vieira 1, Hugo Vilhena 2 3 4, Jose J Cerón 5, Asta Tvarijonaviciute 5 6, José A Montoya-Alonso 7, Elena Carretón 7, Josep Pastor 6PMID: 26783021 DOI: 10.1177/1098612X15625435
- Increased detection of Dirofilaria immitis antigen in cats after heat pretreatment of samplesJeff M Gruntmeir 1, Chris B Adolph 2, Jennifer E Thomas 1, Mason V Reichard 1, Byron L Blagburn 3, Susan E Little 1 PMID: 27694369 DOI: 10.1177/1098612X16670562
- Dirofilarioses in cats: European guidelines from the ABCD on prevention and managementMaria Grazia Pennisi 1, Séverine Tasker 1, Katrin Hartmann 1, Sándor Belák 1, Diane Addie 1, Corine Boucraut-Baralon 1, Herman Egberink 1, Tadeusz Frymus 1, Regina Hofmann-Lehmann 1, Margaret Hosie 1, Albert Lloret 1, Fulvio Marsilio 1, Etienne Thiry 1, Uwe Truyen 1, Karin Möstl 1
PMID: 32326862 DOI: 10.1177/1098612X20917601 - Aberrant migration and surgical removal of a heartworm (Dirofilaria immitis) from the femoral artery of a cat Maureen S. Oldach1 | Catherine T. Gunther-Harrington2 | Ingrid M. Balsa3 |Ehren M. McLarty1 | Kyle A. Wakeman1 | Kathryn L. Phillips3 |Juhana Honkavaara1 | Lance C. Visser2 | Joshua A. Stern2Journal of Veterinary Internal Medicine, 32(2), 792–796. doi:10.1111/jvim.15070
- Dirofilaria immitis in cats: anatomy of a disease.Nelson CT.Compend Contin Educ Vet. 2008 Jul;30(7):382-9; quiz 389.PMID: 18825638 Review.
- Dirofilaria immitis exposure status in client-owned cats with or without lower airway/lung-associated signs: case-control study in a canine heartworm-endemic areaChung-Hui Lin 1 2, Pei-Ying Lo 2, Han-Ju Tsai 2, Lih-Chiann Wang 1 2, Bor-Song Liaw 3, Olivia F Hsieh 2, Yeong-Shuenn Chang 4, Yi-Chin Tsai 5, Szu-Ching Yu 6, Ling-Ling Chueh 1 PMID: 26620647 DOI: 10.1177/1098612X15618704
- First Report on Clinical Feline Heartworm ( Dirofilaria Immitis) Infection in RomaniaD Pană 1, A Rădulescu 1, I L Mitrea 1, M Ionita 1PMID: 32063740 PMCID: PMC6996259 DOI: 10.2478/helm-2020-0009
- High-resolution CT evaluation of bronchial lumen to vertebral body, pulmonary artery to vertebral body and bronchial lumen to pulmonary artery ratios in Dirofilaria immitis-infected cats with and without selamectin administrationTekla M Lee-Fowler 1, Robert C Cole 1, A Ray Dillon 1, Shannon Graham 1, D Michael Tillson 1, Sharron Barney 1PMID: 28994629 DOI: 10.1177/1098612X17734999
- Evaluation of a rapid immunochromatographic test for the detection of low burden Dirofilaria immitis (heartworm) in dogs and catsMarco Genchi 1, Carlo Mangia 1, Nicola Ferrari 2, Sofia Loukeri 3
PMID: 29224180 PMCID: PMC5748436 DOI: 10.1007/s00436-017-5709-2 - Echocardiographic quantification of Dirofilaria immitis in experimentally infected catsC E Atkins 1, R G Arther, D K Ciszewski, W L Davis, S M Ensley, P S Guity, H Chopade, H Hoss, T L SettjePMID: 18926638 DOI: 10.1016/j.vetpar.2008.09.003
- First Autochthonous Infection of a Cat with Dirofilaria immitis in AustriaLisa-Maria Kulmer 1, Maria Sophia Unterköfler 2, Hans-Peter Fuehrer 2, Varvara Janovska 3, Matus Pagac 3, Michaela Svoboda 3, Luigi Venco 4, Michael Leschnik 1PMID: 34578137 PMCID: PMC8466588 DOI: 10.3390/pathogens10091104
- Heartworm prevalence in dogs versus cats: Multiple diagnostic modalities provide new insights
Kellie M Hays 1, Jessica Y Rodriguez 2, Susan E Little 3, Annette L Litster 2, Kennedy K Mwacalimba 4, Kellee D Sundstrom 3, Deborah M Amodie 4, Maria A Serrano 5, Simone D Guerios 5, Jennifer N Lane 1, Julie K Levy 1PMID: 32904770 PMCID: PMC7458388 DOI: 10.1016/j.vpoa.2020.100027 - What is new in the Wolbachia/Dirofilaria interaction?Wieslaw J Kozek 1PMID: 16198819 DOI: 10.1016/j.vetpar.2005.02.005
- Activity of pulmonary intravascular macrophages in cats and dogs with and without adult Dirofilaria immitisA R Dillon 1, A E Warner, W Brawner, J Hudson, M TillsonPMID: 18977090 DOI: 10.1016/j.vetpar.2008.09.004
- Prevalence of naturally occurring Dirofilaria immitis infection among nondomestic cats housed in an area in which heartworms are endemic Clarke Atkins 1, Anneke Moresco, Annette Litster PMID: 16013550 DOI: 10.2460/javma.2005.227.139
- Morphologic changes in the lungs of cats experimentally infected with Dirofilaria immitis. Response to aspirin C A Rawlings 1, R L Farrell, R M Mahood PMID: 2074553 DOI: 10.1111/j.1939-1676.1990.tb03126.x
- Evaluation of pulmonary function variables by using plethysmography in cats with respiratory disease associated to Dirofilaria immitis L García-Guasch 1, A Caro-Vadillo, J Manubens-Grau, E Carretón, R Morchón, F Simón, J A Montoya-Alonso PMID: 22230027 DOI: 10.1016/j.vetpar.2011.12.013
- Physiological and haematological findings and clinical observations in a model of acute systemic anaphylaxis in Dirofilaria immitis-sensitised cats A Litster 1, R Atwell PMID: 16739523 DOI: 10.1111/j.1751-0813.2006.tb12768.x
- Effect of pre-cardiac and adult stages of Dirofilaria immitis in pulmonary disease of cats: CBC, bronchial lavage cytology, serology, radiographs, CT images, bronchial reactivity, and histopathology A Ray Dillon 1, D M Tillson 2, A Wooldridge 2, R Cattley 2, J Hathcock 2, W R Brawner 2, R Cole 2, B Welles 2, P W Christopherson 2, T Lee-Fowler 2, S Bordelon 2, S Barney 2, M Sermersheim 2, R Garbarino 2, S Z Wells 2, E B Diffie 2, E R Schachner 3 PMID: 25288308 DOI: 10.1016/j.vetpar.2014.09.007
- Feline heartworm (Dirofilaria immitis) infection: a statistical elaboration of the duration of the infection and life expectancy in asymptomatic cats Claudio Genchi 1, Luigi Venco, Nicola Ferrari, Michele Mortarino, Marco Genchi PMID: 18922638 DOI: 10.1016/j.vetpar.2008.09.005
- Anthology of Dirofilariasis in Russia (1915-2017) Anatoly V Kondrashin 1, Lola F Morozova 1, Ekaterina V Stepanova 1, Natalia A Turbabina 1, Maria S Maksimova 1, Evgeny N Morozov 1 2 PMID: 32283873 PMCID: PMC7238230 DOI: 10.3390/pathogens9040275
- Detection of Wolbachia DNA in blood for diagnosing filaria-associated syndromes in cats Maria Elena Turba 1, Elisa Zambon, Augusta Zannoni, Samanta Russo, Fabio Gentilini PMID: 22649020 PMCID: PMC3421487 DOI: 10.1128/JCM.00528-12
- Cardio-Pulmonary Parasitic Nematodes Affecting Cats in Europe: Unraveling the Past, Depicting the Present, and Predicting the Future Donato Traversa 1, Angela Di Cesare 1
PMID: 26664917 PMCID: PMC4668853 DOI: 10.3389/fvets.2014.00011 - Cardiopulmonary and inflammatory biomarkers in heartworm disease Elena Carretón 1, Rodrigo Morchón 2, José Alberto Montoya-Alonso 3 PMID: 29143665 PMCID: PMC5688449 DOI: 10.1186/s13071-017-2448-2
- Feline heartworm disease: a clinical review Annette L Litster 1, Richard B Atwell PMID: 18042416 DOI: 10.1016/j.jfms.2007.09.007
- Hematologic and radiographic changes in cats after inoculation with infective larvae of Dirofilaria immitis J M Donahoe, S K Kneller, R E Lewis PMID: 130366 1976 Mar 1;168(5):413-7.
- Understanding feline heartworm infection: disease, diagnosis, and treatment Alice C Y Lee 1, Clarke E Atkins PMID: 21147476 DOI: 10.1053/j.tcam.2010.09.003
- Pulmonary artery dissection causing haemothorax in a cat: potential role of Dirofilaria immitis infection and literature review